ファージ提示法
1. 概要:ファージディスプレイ法(ファージ提示法)
1990年ごろ、ミズーリ大学のG.P.Smithらのグループが、標的分子に結合するペプチド(もしくはタンパク質)をライブラリー群から効率よく選別する方法を提案した[1]。この方法は、「ファージディスプレイ法(ファージ提示法)phage display method」と呼ばれ、標的分子に結合するペプチドまたはタンパク質を同定する手法として多くの研究者によって支持され、瞬く間に広まっていった。またここでライブラリー化されたファージは「ファージライブラリー(phage library)」と名付けられた[2]。
(G.P.Smithら、2018年のノーベル化学賞)https://www.nobelprize.org/prizes/chemistry/2018/press-release/
この方法は、ファージゲノムに任意の遺伝子を組み込むことにより、対応するペプチドおよびタンパク質を繊維状ファージの外殻タンパク質に融合タンパク質として提示させる技術を利用している。1つのファージには個別の遺伝子配列を含むが、これらを集合させた群はライブラリーであり、ファージライブラリーと称される。標的分子(抗体などのタンパク質が多い)とライブラリーを結合反応させ、選択操作を行うことにより、標的分子に結合するファージ群を濃縮することができる。この選択操作はバイオパニング(biopanning)、親和性選択(affinity selection)などと呼ばれる。この方法の最大の利点は、遺伝型と表現型の連結することによるタグ付けであり、ファージゲノムのDNA解析を行えば、単離されたファージが提示しているペプチド(タンパク質)配列を容易に同定することができる。
![図1 繊維状ファージの形状(電子顕微鏡観察、文献[3])。約1 μmで「ひも状」であることがわかる。](https://image.jimcdn.com/app/cms/image/transf/dimension=612x10000:format=png/path/sb09d88ae3dd142c3/image/i87a9ce0ff25a82c4/version/1483840973/image.png)
2. ファージライブラリーの調製
この方法に用いられるファージは大腸菌のウイルスであり、繊維状(f1, fd, M13など、図1)がよく使用されるが、T7型のものでも可能である。 電子顕微鏡観察によると、繊維状ファージ粒子の形状は直径は約6 nm, 長さは約1 μmである[3]。ゲノムである環状1本鎖のsingle strand DNAを含み、その周囲をpVIIIの主要外殻タンパク質(50残基)が取り囲んでいる。
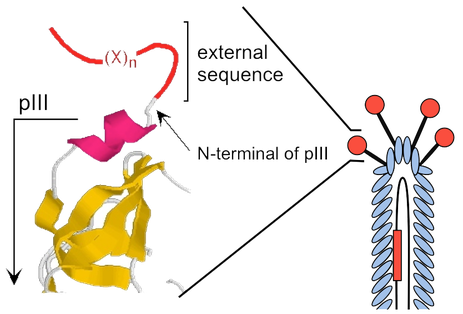
ライブラリーの調製[4]は、まずランダム化したDNA(もしくはcDNAライブラリーなど)を化学合成し、遺伝子工学的手法を用いてファージDNAに挿入する。このDNAを大腸菌に遺伝子導入することでファージウイルスを形成する分子が生合成され、ウイルス粒子の外殻タンパク質pIIIのN末端の先に目的タンパク質が発現される(図2および図3)。

提示に用いられるライブラリーはcDNA、抗体、タンパク質・酵素の一部(およびDNAシャッフリングなど)、短鎖ペプチド(直鎖状および環状) などがある。また、提示される分子数はpIIIタンパク質(図2および3)に提示させる場合では最大3-5コピー、pVIII(外殻主要タンパク質)では 2700コピーであるとされている。
またライブラリーサイズは通常108〜109程度である。これは抗体産生時のライブラリー数に匹敵する。しかし、このサイズで理論上すべての組み合わせを含む残基数は6-7(206=6.4×107)しかできない。実用性を考えるとすべての組み合わせよりも長さが必要な場合があるため、実際には7残基より長いライブラリーを用いた研究も行われている。
現在では、pIIIタンパク質に提示する各種ライブラリーが試薬会社から販売されており(randomized 7 mer, 12 mer, cyclic 7 merなど)[5]、安価で購入することができる(もしくは直接、Smithに連絡をとれば、ファージミドおよび宿主菌を供与してくれる。ただしこの場合は自分で調製しなくてはならない)。
また提示法という技術に関しては、大腸菌の繊毛に提示させたり、酵母の表面に提示させたりする方法も開発されている。
3. セレクション方法(バイオパニング)
ファージライブラリーを用いた「(バイオ)パニング」と呼ばれる選択操作(親和性選択affinity selectionともいう)により、標的分子に結合性のあるファージを得ることができる(図4)[6]。
ファージライブラリー(phage library, 図4の左上)を標的タンパク質などを固定化した96ウェル中でインキュベートし(binding)、洗浄して結合していないファージを取り除く(washing)。結合しているファージを溶出させ(elution)、宿主大腸菌に感染させた後に培養液中で増幅させる(amplification)。増幅されたファージを再び次のラウンドに使用する。このラウンド操作を数回繰り返すことにより、結合活性のあるファージ群を濃縮することができる。
ファージのクローニングを行った後(cloning)、ファージのゲノムDNAを解析することで標的分子に結合性のあるペプチド(タンパク質)のアミノ酸配列を同定する。またDNA解析の前に個々のクローンの結合活性を評価するスクリーニング操作も有効である。
標的分子にはモノおよびポリクローナル抗体、タンパク質受容体、酵素、核酸、複合糖質、低分子化合物、細胞、臓器、プラスチックなど多様なものが用いられている。

References
[1] J.K. Scott, G.P. Smith, Science, 249, pp.386–390 (1990) もしくは G.P. Smith, Science, 228, pp.1315-1317 (1985).
[2] G.P. Smith, V.A. Petrenko, Chem. Rev., 97, pp.391-410 (1997).
[3] R.A. Grant, T.C. Lin, W. Konigsberg, R.E. Webster, J. Biol. Chem., 256, pp.539-546 (1981).
[4] K.A. Noren, C.J. Noren, Construction of high-complexity combinatorial phage display peptide libraries, Methods, 23, pp.169–178 (2001).
[5] New England Biolabs社など. http://www.nebj.jp/product/gr/Phage%20Display/
[6] 成書の例:実験医学別冊 実験ハンドブックシリーズ「分子間相互作用解析ハンドブック」,礒辺 俊明・中山 敬一・伊藤 隆司 監修,羊土社, pp.16-22(2007).
(2018年10月改、ノーベル賞)(2017年作成)
