ガングリオシド結合性ペプチド
はじめに
糖鎖は構成糖やエネルギー源として以外に、タンパク質や脂質と結合して糖脂質、糖タンパク質およびプロテオグリカンなどの複合糖質として存在する。特にスフィンゴ糖脂質および糖タンパク質の末端糖鎖構造は、特定のタンパク質により認識されることで、生体内機能の制御と密接に関係している。これらの糖鎖の関わる相互作用を制御することは糖鎖の機能解明のみならず、薬剤や診断などの医療へ応用できる可能性がある。われわれはこれまでに糖鎖の関わる新規なペプチ ドを効率よく同定する手法を開発し、得られたペプチドが実際に細胞表面の糖鎖機能を制御することを示している。
生理活性オリゴ糖鎖に特異的に結合するペプチドを得る手法
近年、標的分子と高い親和性を持つペプチド配列を効率よく同定する手法が開発されており、そのうちの1つであるファージディスプレイ(提示)法を用いた (図1A)。この手法はランダムなペプチドライブラリーから、目的の結合活性を持つアミノ酸配列のみを取り出す技術である。準備できるライブラリーの多様 性は〜109であり、ペプチドの提示体として用いられる微生物ファージ粒子が安定で選択条件に都合がよい。またここで、効率的にオリゴ糖鎖とペプチドラ イブラリーを相互作用させるため、糖脂質を気/水界面で配向固定した糖鎖の単分子膜面を用いた(図1B)[1]。単分子膜を用いることにより、特異的に結合する 配列を同定することができる。

GM1に結合するペプチドの同定と糖鎖
シアル酸を有するスフィンゴ糖脂質であるガングリオシドGM1はコレラ毒素の受容体であり、脂質ラフトの分子マーカーとしても使われている。上述の方法 で、GM1に結合する15残基のペプチドをペプチドライブラリーから同定した[1]。このペプチドはGM1糖鎖に特異的に結合し、糖鎖の構造を見分け
ていることがわかった[2]。タンパク質のコレラ毒素と同じく、末端のガラクトースとシアル酸を認識した。またこのペプチドはコレラ毒素の糖鎖認識サ ブユニットの結合を阻害し、阻害剤として機能した。
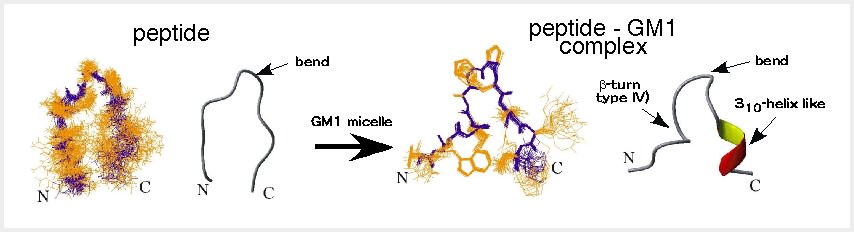
最も結合活性の高かったペプチドp3は解離定数Kdで1μMであり、糖鎖結合性タンパク質であるレクチンと同程度の結合親和性を有していた。このペプチ ドの溶液中の2次元核磁気共鳴スペクトル(NMR)を測定して構造解析を行ったところ、ペプチドはinduced-fitでGM1糖鎖を認識することがわ
かった(図2)[3]。短いペプチドでこのような構造変化をする人工ペプチドは珍しい。
アミロイドβタンパク質の重合に関わるGM1を認識する
アルツハイマー病患者の脳では海馬で顕著にAβの沈着がみられる。このAβの重合の促進はGM1によってもおきるが、細胞表面のすべてのGM1分子が関 わる訳ではない。Aβ重合のきっかけとなるGM1は、Aβと複合体(GAβ)を形成し、神経毒性のあるAβオリゴマーの重合を促進する。このGAβは神経 細胞のシナプス末端に存在する。このGAβを形成するGM1は脂質ラフト中に存在し、p3が特異的に認識する高い密度の状態を維持していることがわかった [4]。そこで若齢および老齢のマウス脳の海馬を単離し、シナプトソーム(シナプス末端の機能を維持した画分)との相互作用を測定したところ、p3によって検出される領域はAβ重合の領域とよい相関性を示し、p3がGAβ形成の関わるGM1を特異的に認識することが示された。コレラ毒素はこの特異性は ないことから、人工のペプチドに天然タンパク質にはない新しい機能を付与することができることがわかった。
ヘリックス形成するペプチドによるGM1認識
p3のように短いペプチドは立体構造を維持しにくく、GM1と相互作用する際のコンホメーション変化によるエントロピー損失をまぬがれない。そこで立体 構造を形成できるヘリックス-ループ-ヘリックス構造を持つペプチドの一部をランダム化したライブラリーを作成し、GM1に対して親和性選択を行った(図 3)。その結果、ヘリックス構造を形成するGM1を認識する配列B72が得られた[5]。このペプチドはp3と比較すると結合親和性が5倍向上した。 ペプチドの立体構造は認識に重要であることがわかった。de novo設計したペプチドでも望みの糖鎖認識能を付与させることができることがわかった。

モノシアリル、ジシアリル、トリシアリルガングリオシドに対する選択
ガングリオシドはGM1以外にも、モノシアリルガングリオシドとしてGM2やGM3があり、ジシアリルガングリオシドのGD1aやGD3がある(図4)。さらにトリシアリルガングリオシドとしてGT1bは破傷風毒素の受容体として知られている。抗体やレクチンのように、オリゴ糖鎖を見分けることができる分子は有用である。
上述するGM1と同じように、GM2, GM3, GD1a, GT1b単分子膜を用いたランダムペプチドライブラリーからのファージディスプレイ選択により、各ガングリオシドに結合するペプチドを同定した。例えばGT1b結合性ペプチドは、シアリルオリゴ糖中のシアル酸の数に依存して結合活性は増加し、GT1bに対して最も高い親和性を有していた。

得られたペプチドの共通モチーフは、GM1-、GM2-、GM3-またはGD1a結合ペプチドのものとは異なっていた(表1)。共通モチーフはArg、Serおよび疎水性アミノ酸を含み、糖鎖認識に寄与すると考えられた。モチーフはガングリオシドに依存したが、アミノ酸は共通していることが示された。

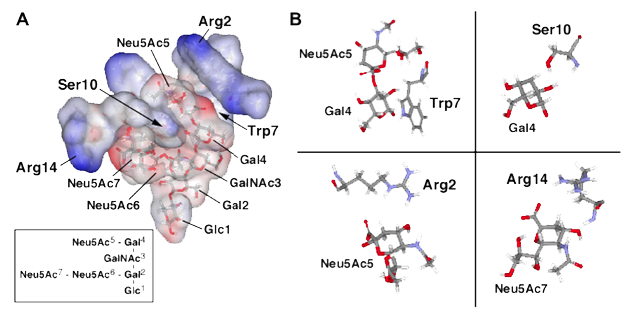
図5には、GT1b結合性ペプチドc10とGT1bの分子モデリングを示した。Trp7とGal4の積み重ねが複合体における重要な相互作用であると仮定すると、Ser10の側鎖とGal4の2-OHとの間の水素結合、さらにArg2のグアニジウム基とNeu5Acのカルボキシル基の炭素原子間の距離も近いことが示唆された。
References
(1) T. Matsubara, D. Ishikawa, T. Taki, Y. Okahata, T. Sato, Selection of ganglioside GM1-binding peptides by using a phage library, FEBS Lett. 456(2), 253-256
(1999).
(2) T. Matsubara, K. Iijima, M. Nakamura, T. Taki, Y. Okahata, and T. Sato, Specific binding of GM1-binding peptides to high-density GM1 in lipid membranes, Langmuir,
23(2), 708-714 (2007).
(3) N. Fujitani, H. Shimizu, T. Matsubara, T. Ohta, Y. Komata, N. Muira, T. Sato, and S.-I. Nishimura, Structural Transition Study of a Fifteen Amino Acid Residue Peptide Induced by
GM1, Carbohydr. Res., 342(12-13), 1895-1903 (2007).
(4) N. Yamamoto, T. Matsubara, T. Sato, and K. Yanagisawa, Age-dependent high-density clustering of GM1 ganglioside at presynaptic neuritic terminals promotes amyloid β-protein
fibrillogenesis, Biochim. Biophys. Acta, 1778, 2717-2726 (2008).
(5) T. Matsubara, M. Iida, T. Tsumuraya, I. Fujii, and T. Sato, Selection of carbohydrate-binding domain with a helix-loop-helix structure, Biochemistry, 47(26),
6745-6751 (2008).
(6) Teruhiko Matsubara, Ai Onishi, and Toshinori Sato, Carbohydrate recognition by pentadecapeptide ligands for a series of sialylated oligosaccharides , Bioorg. Med. Chem., 20(21), 6452-6458 (2012).
(2017年作成)
